
Autores:
La insuficiencia cardiaca (IC), se define como la incapacidad del corazón para realizar su función de forma adecuada (no es capaz de bombear la sangre para hacer que esta llegue al organismo y/o se produce un aumento en las presiones de llenado del corazón). Esto se manifiesta a través de una serie de síntomas característicos como la fatiga o el cansancio, la falta de aire y la retención de líquidos, que puede ocurrir en los pulmones, o en otras partes del cuerpo como las piernas y el abdomen. Existen múltiples causas de IC. En general, se debe al deterioro de la función del corazón, secundaria entidades como la hipertensión arterial crónica mal controlada, enfermedad valvular, enfermedad de las arterias coronarias, y otras causas menos comunes como la miocarditis o las arritmias (Tabla I).

Existen dos tipos fundamentales de IC:
Para realizar un correcto diagnóstico es fundamental realizar una historia clínica completa y una exploración física que identifique todos los signos y síntomas típicos de la IC, así como la realización de pruebas complementarias como el electrocardiograma, el ecocardiograma, ergometría, analíticas de sangre y radiografía (Figura 1).

La IC es en la actualidad una de las principales causas de hospitalización y fallecimiento en los países desarrollados. Si bien puede manifestarse a cualquier edad, su frecuencia aumenta claramente con el avance de la edad. De esta manera, se estima que alrededor del 1 - 2% de la población adulta tiene IC y este porcentaje es mayor del 10% en aquellos mayores. Los grandes avances alcanzados en el campo de la cardiología, tanto en los tratamientos farmacológicos como intervencionistas, han conseguido mejorar notablemente la supervivencia de los pacientes con enfermedades cardiacas.
Esto, junto con el envejecimiento de la población, hacen que la prevalencia de la IC este en continuo aumento, convirtiéndose en uno de los principales focos de atención del sistema sanitario.
Las manifestaciones clínicas de la IC pueden incluir:
Síntomas causados por la acumulación de líquido o congestión
Síntomas relacionados con la falta de flujo sanguíneo en el cuerpo
Otros síntomas
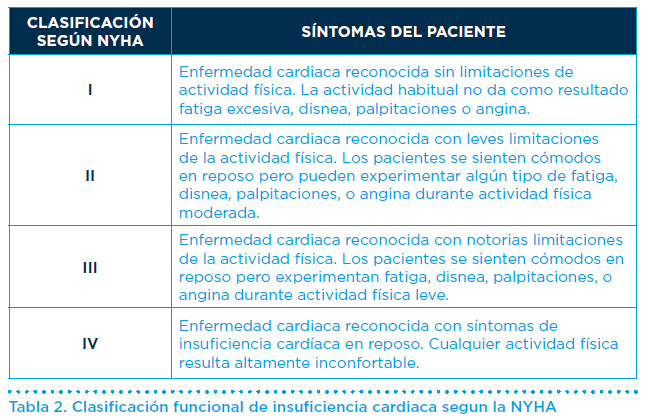
En la práctica clínica se utiliza la clasificación funcional de la NYHA (New York Heart Association) para describir la severidad de los síntomas y la intolerancia al ejercicio (Tabla II). Esta sencilla clasificación permite a los cardiólogos estratificar la situación clínica de los pacientes y guiar su tratamiento.
El tratamiento de la IC se debe realizar de forma individualizada y dirigida en función de la causa y del tipo de IC que tiene cada paciente. Incluye el uso de medicamentos y en algunos pacientes de dispositivos, dirigidos tanto a mejorar la función del corazón como a aliviar los síntomas. Además, es fundamental el manejo de otras enfermedades que pueden empeorar de forma significativa la situación clínica de los pacientes con IC, como la diabetes, la hipertensión arterial y la anemia. Los fármacos empleados en el manejo de la insuficiencia cardiaca van destinados fundamentalmente a “descargar” de trabajo al corazón y aliviar los síntomas congestivos (Tabla III).

Dado que la IC es una entidad crónica que requiere un manejo médico a largo plazo, la participación de los pacientes en su autocuidado es fundamental para mejorar su pronóstico y evitar las hospitalizaciones frecuentes. Este autocuidado incluye una buena relación con el médico, la adherencia al tratamiento farmacológico, el cumplimiento de las restricciones en la dieta y los cambios en el estilo de vida, que incluyen el compromiso con un régimen de ejercicio físico. La participación, de los pacientes en su autocuidado, unido al apoyo médico adecuado son fundamentales para mejorar los síntomas, evitar la progresión de la IC y mejorar la calidad de vida.
Algunos de los síntomas que experimentan los pacientes con IC, como la falta de aire, el cansancio y la fatiga se relacionan precisamente con los esfuerzos físicos. Esta situación conduce al temor al ejercicio físico, por lo que los pacientes reducen drásticamente su actividad física, hasta niveles que les permitan vivir de forma confortable todos los días, libres de síntomas. A su vez, el sedentarismo y la inmovilidad conducen al desacondicionamiento muscular y al aumento de peso, iniciando un círculo vicioso que conduce a un empeoramiento de los síntomas de forma progresiva.
Los beneficios derivados de la actividad física, y más específicamente, del deporte estructurado han sido demostrados ampliamente. Varias revisiones sistemáticas han demostrado que la realización de ejercicio físico de forma rutinaria por parte de los pacientes con IC mejora su consumo máximo de oxígeno (VO2max) (indicador del metabolismo), su tolerancia al ejercicio, la calidad de vida e incluso reduce la tasa de hospitalizaciones, sin asociarse con ningún efecto perjudicial sobre el corazón. De hecho, las guías europeas de práctica clínica recomiendan la realización de ejercicio físico de forma rutinaria y la inclusión de los pacientes con IC en programas estructurados de rehabilitación cardiaca.
Por lo tanto, los cardiólogos recomendamos a todos los pacientes con IC cambios en el estilo de vida que promuevan la actividad física y la inclusión en programas de ejercicio físico estructurado. Los cambios de estilo de vida implican la promoción de actividades cotidianas comunes como caminar a paso ligero, subir escaleras (en vez que tomar el ascensor), hacer trabajos manuales en casa o jardín, y participar en actividades recreativas activas como salir a dar paseos o jugar con hijos y nietos (Figura 2).

En relación, a la implementación de programas de ejercicio físico estructurado, se requiere una selección apropiada de pacientes y de un programa de entrenamiento adecuado.
En primer lugar, se recomienda el inicio de entrenamiento físico para los pacientes que tengan una clase funcional de la NYHA I-III estable, independientemente del tipo de IC (IC con fracción de eyección deprimida o preservada) y de la cardiopatía de base. En los pacientes con IC avanzada (NYHA IV) o IC descompensada (aquellos pacientes que precisan ingreso hospitalario y/o cambios en su tratamiento habitual por empeoramiento de síntomas) la actividad deportiva estructurada está contraindicada de forma temporal, recomendándose sin embargo, la movilización precoz y gradual para prevenir el desacondicionamiento.
Una vez identificados los pacientes candidatos, se debe realizar un screening individualizado para identificar posibles contraindicaciones para la práctica deportiva (Tabla IV) que incluya una historia clínica, exploración física, ECG, prueba de esfuerzo y ecocardiograma.

Finalmente, se debe seleccionar el tipo de deporte que practicará el paciente. No existe un acuerdo universal sobre el tipo de ejercicio que deben realizar los pacientes con IC, por lo tanto, la selección debe ser de forma individualizada, teniendo en cuenta la edad, la situación laboral, los hábitos de ocio, las preferencias y habilidades de los pacientes, así como la disponibilidad de instalaciones y equipo deportivo. La identificación del deporte apropiado y de la intensidad adecuada es crucial para obtener los beneficios deseados mientras se mantiene control razonable de los posibles riesgos (Figura 3).

Es importante recordar que un nivel de actividad física insuficiente sin criterios que justifiquen la restricción puede ocasionar una gran insatisfacción personal, además de no conseguir los efectos beneficiosos esperados sobre la propia enfermedad.
Existen dos modalidades fundamentales de entrenamiento:
El entrenamiento cardiovascular es aquel en el que se realiza un trabajo muscular dinámico, en el que participan grandes grupos musculares. Este tipo de ejercicio aporta mayores efectos beneficiosos a nivel cardiovascular y es recomendado de forma sistemática en las guías de práctica clínica. Incluye actividades como caminar, correr, montar en bicicleta, nadar y bailar.
La prescripción de la intensidad de ejercicio aeróbico debe ser individualizada, y se basará en los resultados de la prueba de esfuerzo, las características del paciente y el grado de entrenamiento previo. El tanto por ciento del esfuerzo máximo recomendado varía según el parámetro utilizado para medir el trabajo. En general, el ejercicio aeróbico para pacientes con IC se prescribe a un 70% u 80% de la frecuencia cardíaca máxima alcanzada en la prueba de esfuerzo convencional.
Algunos centros disponen de la prueba de esfuerzo con consumo de oxígeno (VO2), que mide de forma objetiva el metabolismo y la capacidad funcional máxima de un individuo. En casos seleccionados (por ejemplo, pacientes con fracción de eyección deprimida) se pueden utilizar los valores de VO2 máximo, así como los valores del umbral aeróbico y anaeróbico para prescribir la intensidad del ejercicio. En pacientes cardiológicos o personas mayores se suele prescribir trabajar en zonas cercanas al primer umbral, que puede variar entre el 50 y el 75% (iniciar en el 40-50% y progresar hasta el 70-80% del VO2 máximo) y en personas sanas también se utiliza los valores del segundo umbral (ver capítulo 3 y 15).
Se recomienda iniciar con 5-10 minutos de entrenamiento de baja intensidad, 2 veces a la semana, e ir progresando hasta sesiones de 45 – 60 minutos de alta intensidad y 3-5 veces por semana. Uno de los ejercicios físicos realizados con más facilidad es caminar, ya que es un deporte sencillo, barato, que se puede realizar al aire libre, en instalaciones deportivas o en casa. Involucrar a la familia para apoyar al paciente contribuye en gran medida a fomentar el cumplimiento de la actividad deportiva. Algunos de estos deportes se pueden practicar en compañía, algo que les da una dimensión social muy valorada por algunos pacientes.
El ejercicio de tonificación muscular es aquel en el que se busca una contracción muscular sostenida contra una resistencia fija, por lo que fortalece y tonifica los músculos, mejora la flexibilidad y aumenta la masa ósea. Hasta hace unos años se consideraba que el ejercicio de fuerza podía ser perjudicial al favorecer el remodelado negativo del ventrículo izquierdo como consecuencia del aumento de la pos-carga. Sin embargo, hoy en día existe evidencia de su utilidad para evitar la pérdida de masa muscular y su impacto positivo en la capacidad funcional y en la calidad de vida de los pacientes.
Dentro del trabajo de tonificación muscular queda implícito el trabajo de movilidad articular (flexibilidad), para conseguir un máximo rendimiento, así como una reducción de las lesiones.
Al igual que en el ejercicio cardiovascular, se puede trabajar de forma aeróbica o de resistencia, con ejercicios con poco peso y muchas repeticiones, o de forma anaeróbica, con mucho peso y pocas repeticiones, “fuerza máxima”. Para ahondar en este trabajo acudir al capítulo 15.
En el caso de pacientes cardiológicos, el ejemplo más característico es el levantamiento de pesas y se recomiendan ejercicios que combinen poco peso con mucho movimiento. Las cargas iniciales de entrenamiento de la fuerza deben ser livianas y los pacientes deben completar 6 – 15 repeticiones de ejercicios dirigidos a los músculos superiores e inferiores, uno o dos días por semana. Es importante enseñar a los pacientes que durante los ejercicios de fuerza debe evitar realizar maniobras de Valsalva (contención de la respiración) y tener la presión arterial bien controlada.
Las sesiones de ejercicio físico deben iniciar siempre con un periodo de calentamiento, en el que se realizan ejercicios a menor intensidad para preparar el sistema muscular y el corazón, y finalizar con un periodo de enfriamiento o vuelta a la calma, con disminución progresiva de la intensidad del ejercicio y ejercicios de estiramiento para evitar lesiones musculares.
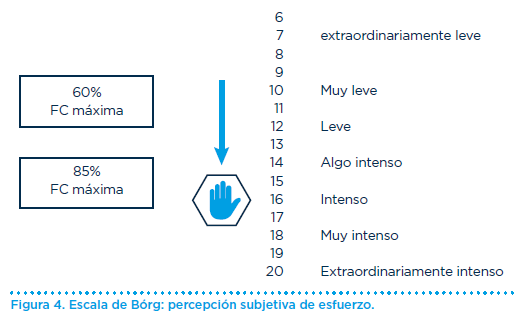
Finalmente, haremos mención a una herramienta para calcular la intensidad del entrenamiento, basada en la sensación de esfuerzo percibida por una persona mientras realiza el ejercicio, la escala de Börg (Figura 4). Es un método validado y fácil de utilizar para todos los pacientes mientras realizan cualquier tipo de ejercicio. Se trata de una escala con valores de 6 a 20, en la que un valor de 12 a 13 (esfuerzo medio) corresponde a un 60% del VO2 máximo y un valor de 16 (esfuerzo intense y muy intense) corresponde a un 85% del VO2 máximo. Se recomienda un aumento progresivo de la intensidad del ejercicio de acuerdo con la escala de Börg hasta un valor de 12-13 y siempre por debajo de 15.
La incidencia de las enfermedades valvulares ha cambiado en nuestro medio en los últimos años. La patología valvular sigue teniendo una prevalencia relevante en cualquier servicio de cardiología, al emerger las de etiología degenerativa o no reumáticas y persistir con menor incidencia las valvulopatias congénitas. A pesar de que la patología valvular es tan común y que en la mayor parte de los casos los sintomas tienen como factor desencadenante y limitante el esfuerzo, existen pocos trabajos en los que se estudie la respuesta y limitación de estos pacientes al ejercicio.
En el diagnóstico de las valvulopatías se utilizan el ecocardiograma Doppler bidimensional y excepcionalmente el cateterismo cardíaco. Para la valoración de la capacidad funcional no basta con la historia clínica y es necesaria la realización de una prueba de esfuerzo, bien en tapiz rodante o en cicloergómetro, es excepcional que precise un estudio hemodinámico.
Debemos tener en cuenta que no se disponen de estudios prospectivos en atletas, por lo que la mayoría de recomendaciones se basan en estudios de cohortes de individuos no atletas con valvulopatía y consensos de expertos, con nivel de evidencia C por tanto.
Según las Guías Americanas de 2014 del manejo de pacientes con enfermedad valvular define 4 estadios que son útiles para sub-clasificar a pacientes con enfermedad valvular mitral y aórtica, de acuerdo con el riesgo que implica la realización de la actividad física.
La elección del tipo de deporte es un aspecto importante para pacientes valvulares en estadios A, B, C, mientras los pacientes sintomáticos en estadio D no son candidatos para el deporte y generalmente son referidos a cirugía.
Los deportes se clasifican con el fin de establecer recomendaciones o prohibiciones de su uso para deportistas portadores de enfermedad cardiaca.
Las actividades pueden clasificarse en funcion del tipo y la intensidad del ejercicio practicado. El ejercicio, a su vez, puede dividirse en dos tipos principales:
Esta clasificación, se ha basado en la construcción de una tabla que caracterizaba los deportes en primer lugar por su componente de resistencia, expresado como la intensidad de contracciones musculares estáticas y en segundo lugar su componente dinámico, reflejado por la intensidad relativa de ejercicio dinámico (contracción regular de grandes grupos musculares).
La clasificación del deporte describe ambos componentes en cada uno de ellos (Tabla V).

Tabla V.
Las contracciones estáticas estimulan los procesos mecanicos y metabólicos del músculo esquelético, lo que conduce a cambios en la presión arterial. Cuanto mayor sea la masa muscularimplicada, mayor la intensidad de la contraccion y mayor es el aumento de la presion arterial; la incorporacion de una maniobra de Valsalva durante las contracciones aumenta de forma aguda y transitoria la presión arterial.
El ejercicio dinámico implica cambios en la longitud muscular y movimiento de articulaciones con contracciones rítmicas, que desarrollan una fuerza intramuscular relativamente pequena. El ejercicio dinámico aumenta la demanda de flujo sanguíneo y de gasto cardíaco, que se produce sin aumento de
la presion.
Estos dos tipos de ejercicio deberian ser considerados como los dos extremos de un espectro continuo de actividades con componentes estático y dinámico. Tanto el ejercicio dinámico como el estatico resultan en un aumento en la demanda miocárdica de oxigeno.
Durante el ejercicio dinámico de alta intensidad, existe un aumento de la frecuencia cardíaca y un aumento en el volumen de eyección del corazón. En el ejercicio estático de alta intensidad, ocurre un aumento menor de la frecuencia cardíaca, y poco o nada en el volumen de eyección del corazón; sin embargo, la presión arterial y el estado contráctil del corazon aumentan de forma considerable.
Así, el ejercicio dinámico produce una sobrecarga de volumen, mientras que el ejercicio estático una sobrecarga de presión. Desde el punto de vista cardiovascular siempre es mas cardiosaludable el dinamico que el estático.
Pero prácticamente todos los deportes tienen una mezcla de ambos esfuerzos. Si ambos componentes son altos, como en los deportes de remo, la adaptación cardiaca que se tiene que producir es una de las mas importantes de todos los deportes.
A continuación, se analiza la etiología, fisiopatología, clínica, diagnóstico de cada una de las anomalías valvulares y se dan unas recomendaciones generales en relación con el tipo de actividad que razonablemente, cada valvulopatía permite realizar.
Esta patología es aún responsable de algunos casos de muerte súbita en atletas jóvenes (<4% de los casos). La etiología más frecuente es la estenosis degenerativa, sin olvidar la válvula aórtica bicúspide, relativamente común en atletas jóvenes (1,5 al 2% de 233 la población general), así como la afectación reumática, aún frecuente en atletas de países en vías de desarrollo.
La ecocardiografía doppler es el método diagnóstico de elección, que nos permitirá determinar la morfología valvular, velocidad del jet, gradientes y área valvular (Figura 5). Es importante también valorar el tamaño y morfología de la aorta ascendente a fin de excluir patología aórtica asociada.
Ante la posibilidad de infraestimación de gradientes, deben considerarse otros estudios en casos de estenosis leve-moderada por ecocardiograma y síntomas discordantes o hipertrofia ventricular izquierda.
La ergometría puede ser también de utilidad para confirmar con objetividad si el paciente se encuentra asintomático, detectar hipotensión durante el ejercicio o cambios electrocardiográficos.

Evaluación
En atletas con válvula aórtica bicúspide sin estenosis (estadio A), se recomienda exploración física anual para detectar la aparición de nuevos soplos.
En caso de estenosis levemoderada (estadio B), debe realizarse anualmente examen físico y ecocardiografía para evaluar la severidad.
La ergometría debe realizarse sí existe EAo leve-moderada, para estar seguro de que la tolerancia es adecuada a la actividad física que se propone y que no desarrolla hipotensión arterial o evidencia de isquemia en el electrocardiograma.
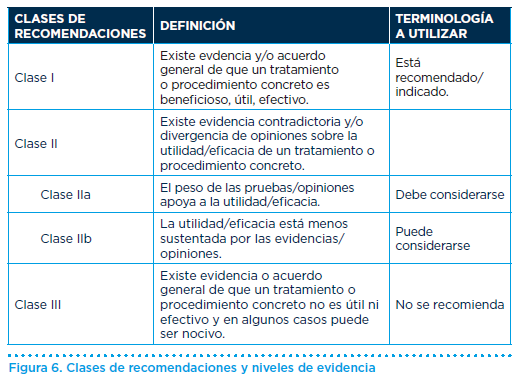
Recomendaciones (niveles de recomendación figura 6):
La insuficiencia aórtica se produce cuando la válvula aórtica no cierra completamente y permite la regurgitación de la sangre desde la aorta al ventrículo izquierdo durante la diástole. Las causas más comunes son:
La sobrecarga de volumen que conlleva la insuficiencia aórtica crónica da lugar a dilatación del ventrículo izquierdo y, a la larga, puede conducir a depresión de la función sistólica. El proceso es lento y el individuo suele permanecer sin síntomas durante años. En esta fase el diagnóstico se realiza por el examen físico con amplitud de pulso aumentada y soplo diastólico en el borde esternal izquierdo, también puede existir un soplo sistólico eyectivo por la sobrecarga de volumen.
El ecocardiograma confirma la regurgitación aórtica y gradúa la severidad. La IAo produce sobrecarga de volumen que es bien tolerada durante décadas.
El paciente con insuficiencia aórtica ligera a moderada suele permanecer sin síntomas y tolerar bien el ejercicio físico. Sin embargo, cuando la dilatación del ventrículo izquierdo aumenta, puede llegar a producirse limitación con los esfuerzos de mayor intensidad, sobre todo si ya ha comenzado la disfunción sistólica ventricular.
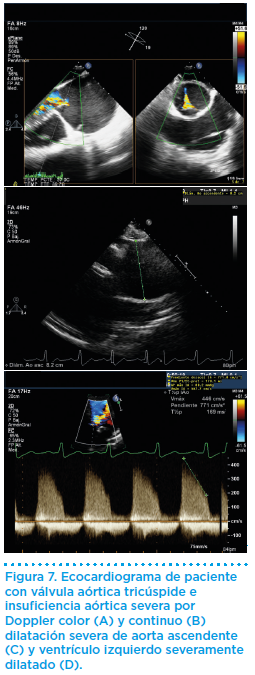
En la evaluación ecocadiográfica (Figura 7) en deportistas nos encontraremos la dificultad añadida de distinguir qué grado de dilatación ventricular es producido por la insuficiencia y cuál es debido a la adaptación al entrenamiento de los deportistas. Hasta un 45% de los varones atletas tienen diámetro telediastólico de ventrículo izquierdo (DDVI>55mm, solo el 14% presentan DDVI > 60 mm).
Por lo tanto, un diámetro telediastólico del ventrículo izquierdo superior a 60 mm en hombre o 55 mm en mujeres debe hacer sospechar que se trata de una dilatación patológica, por lo que en estos casos los deportistas deben ser valorados y vigilados más estrechamente. Del mismo modo el límite superior en atletas para el diámetro sistólico de ventrículo izquierdo (DSVI) es 49 mm en varones y 38 mm en mujeres.
Existen valores de referencia publicados sobre diámetros ventriculares (LVEDD y LVESD) en atletas de ambos sexos, absolutos e indexados, que pueden ser útiles para establecer el diagnóstico diferencial. En atletas con IAo severa que excedan esos valores, podemos sospechar que la dilatación será más probablemente debida a su valvulopatía, y debe valorarse la disminución de la intensidad del ejercicio para evitar mayor dilatación y deterioro ventricular.
Un parámetro importante a evaluar es la fracción de eyección del ventrículo izquierdo. Se considera significativa una fracción de eyección inferior al 50%, ya que indica disfunción sistólica. Así mismo, el diámetro telesistólico del ventrículo izquierdo también es un parámetro valioso en la evaluación, ya que cuando es superior a 50 mm en el hombre o 40 mm en la mujer puede indicar que existe disfunción sistólica ventricular.
Evaluación
Todos los atletas con insuficiencia aórtica deben ser sometidos anualmente a ecocardiograma y prueba de esfuerzo. La medición seriada de los diámetros ventriculares y la función sistólica del ventrículo izquierdo (FEVI,) que suele mantenerse preservada hasta grados severos de dilatación ventricular, será útil en el seguimiento. Los pacientes con IAo a menudo tienen válvula aórtica bicúspide. En estos pacientes es importante medir el diámetro de la aorta, ya que en algunas pacientes se produce dilatación de la misma asociada, en estos es fundamental evaluar la raíz aortica y la aorta ascendente, para excluir aortopatía.
Recomendaciones
La válvula aórtica bicúspide está presente en el 1-2% de la población, es un marcador de enfermedades del tejido conectivo que afecta a la válvula aórtica y a la aorta. Estos pacientes tienen riesgo de EAo e IAo y también de dilatación aórtica y disección
aórtica, aunque el riesgo de eventos es bastante pequeño, y tampoco se sabe si la restricción de la actividad física limita el riesgo de eventos de dilatación y disección.
Evaluación
Los pacientes con aorta bicúspide deben realizarse ecocardiografía para evaluar la función valvular y el tamaño de la aorta en los senos de Valsalva y en la aorta ascendente.
Estenosis Mitral (EMi)
La estenosis mitral, es la situación en la que se produce una reducción del orificio de apertura de la válvula mitral, lo que dificulta el flujo diastólico que pasa desde la aurícula izquierda al ventrículo izquierdo.
La causa predominante de la estenosis mitral es la enfermedad reumática crónica. Existen otras causas menos frecuentes como la estenosis mitral congénita y la secundaria a enfermedades reumatológicas. Masas auriculares, como trombos, mixoma, vegetaciones, pueden obstruir el orificio mitral y simular una estenosis mitral. La calcificación del anillo mitral sí es importante, puede dificultar la apertura de la válvula y producir estenosis mitral.
La estenosis mitral se suele desarrollar lentamente tras el episodio de fiebre reumática aguda y pueden pasar 20-30 años antes de que aparezcan los primeros síntomas.
Al progresar la estenosis mitral, aumenta la presión en la aurícula izquierda, lo que hace que esta se dilate. Posteriormente, aumenta la presión pulmonar, lo que provoca disnea de esfuerzo posteriormente de reposo con ortopnea y finalmente edema agudo de pulmón. La hipertensión pulmonar produce hipertrofia y dilatación de las cavidades derechas, lo que finalmente lleva a insuficiencia cardiaca derecha. El estiramiento y separación de las fibras musculares auriculares, da lugar a la formación de focos ectópicos, apareciendo extrasístoles auriculares y, a largo plazo, a fibrilación auricular. La reducción del gasto cardiaco puede dar lugar a astenia y mareo. Los pacientes con fibrilación auricular pueden referir palpitaciones y molestia precordial atípica.
Un pequeño número de pacientes con estenosis mitral llega a sufrir angina. El embolismo sistémico era otra complicación relativamente frecuente en la estenosis mitral, llegando a producirse en el 20% de los casos, pero ha disminuido drásticamente con la introducción de la anticoagulación y la cirugía valvular mitral.
Desde el punto de vista de la prescripción de ejercicio físico, la estenosis mitral no forma parte del grupo de cardiopatías con riesgo de muerte súbita. La sintomatología que presentan estos pacientes les impide desarrollar una actividad física normal. Quedan autoexcluidos de la práctica deportiva sin necesidad de establecer recomendaciones. Pero en caso de estenosis leve-moderada pueden persistir asintomáticos incluso con ejercicio de alta intensidad. En estos pacientes, el incremento de frecuencia cardiaca y gasto cardiaco con el ejercicio provoca un aumento de la presión capilar pulmonar que puede llegar a desencadenar episodios de edema agudo de pulmón. Otro factor para tener en cuenta es el riesgo de fibrilación auricular en grados de EM incluso leves y la consecuente necesidad de anticoagulación que puede limitar la práctica de algunos deportes.
El mecanismo fisiopatológico de la limitación al esfuerzo en la estenosis mitral es la obstrucción del flujo sanguíneo de la aurícula izquierda al ventrículo izquierdo (Figura 8).
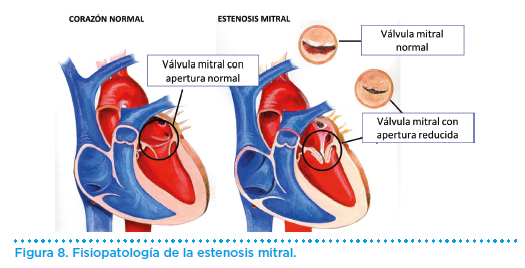
Esto provoca un incremento de la presión auricular izquierda y retrógradamente de la capilar pulmonar en reposo. Durante el ejercicio el fenómeno es más acusado al reducirse el período de llenado diastólico por la taquicardia.
La gravedad de la estenosis se valora inicialmente mediante la exploración física, el ECG, la radiografía de tórax. La ecocardiografía nos permitirá determinar los gradientes valvulares y el área estimada (AVM). La estenosis mitral se clasifica como severa cuando el área valvular es menor de 1 cm2. Debemos tener en cuenta que el gradiente medio es un parámetro muy dependiente del flujo transvalvular y del periodo diastólico, por lo que puede variar mucho con el incremento de FC durante el ejercicio. Un gradiente medio >15 mmHg o presión de la arteria pulmonar PAP >25 mmHg en ejercicio es indicativo de EM significativa. La determinación indirecta de las presiones pulmonares (PAP) mediante ecocardiografía puede ayudar a la toma de decisiones.
Evaluación
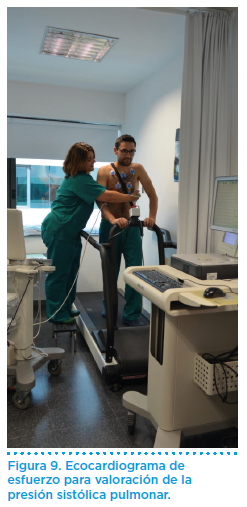
La prueba de esfuerzo es útil para establecer el grado de repercusión funcional y comprobar la FC durante el ejercicio. Una respuesta rápida empeora la capacidad de esfuerzo, de tal forma que se produce disociación entre grado de estenosis y tolerancia al esfuerzo. La prescripción de un fármaco con propiedades cardio-frenadoras alivia la sintomatología y mejora la tolerancia al esfuerzo. La medida de la presión sistólica pulmonar con el ejercicio estimada mediante ecocardiografía de esfuerzo en cinta o cicloergómetro puede ser muy útil para la toma de decisiones de la actividad que puede realizar de forma segura (Figura 9). Del mismo modo, la prueba de esfuerzo con estudio de la función cardiopulmonar (VO2máx) es útil para determinar con criterios objetivos cuál es el grado de repercusión funcional.
Recomendaciones
La insuficiencia mitral puede ser causada por diversas anomalías, pero la consecuencia es que la sangre regresa a la aurícula izquierda durante la sístole, debido a que la válvula mitral no se cierra completamente.
Actualmente la causa más habitual es el prolapso mitral (enfermedad mixomatosa). Otras causas son la enfermedad reumática, la endocarditis infecciosa, las enfermedades del tejido conectivo (como el síndrome de Marfan). Además, existen formas secundarias a la enfermedad coronaria y la miocardiopatía dilatada que condicionan restricción del cierre valvular.Las recomendaciones para el ejercicio físico y el deporte en personas con insuficiencia mitral varían según la causa de la valvulopatía. En los pacientes con enfermedad coronaria o miocardiopatía dilatada son estas enfermedades las que condicionan las recomendaciones, más que la propia insuficiencia mitral.
La IMi se detecta por un soplo sistólico típico, y es la ecocardiografía quién confirma y gradúa la severidad. La severidad del IM está relacionada con la magnitud de la regurgitación, que produce dilatación del ventrículo izquierdo y aumento de presión y volumen de la aurícula izquierda. La prueba de esfuerzo con cálculo de parámetros cardiorespiratorios (VO2max) es muy útil para conocer la repercusión sobre la capacidad funcional.
La mayoría de las personas con insuficiencia mitral leve o moderada no tiene síntomas (estadio B). En estos casos, los mecanismos de compensación cardiovasculares son suficientes para mantener un gasto cardiaco adecuado sin un aumento importante de la presión venosa pulmonar, por lo que el individuo no presenta síntomas. Sin embargo, cuando la insuficiencia mitral se hace severa, las alteraciones hemodinámicas superan los mecanismos de compensación, lo que lleva a un aumento de la presión venosa pulmonar, que produce disnea (dificultad respiratoria), y a reducción del gasto cardiaco. La insuficiencia mitral se tolera mejor que la estenosis y tampoco presenta riesgo de muerte súbita, salvo en casos avanzados con gran dilatación del ventrículo y disminución de la contractilidad.
Dado que el entrenamiento de los deportistas puede llevar a dilatación fisiológica del ventrículo izquierdo, puede ser difícil valorar la repercusión de la insuficiencia mitral sobre el corazón. Sin embargo, sí el diámetro telediastólico del ventrículo izquierdo es superior a 60 mm, la insuficiencia mitral es severa y quizás pueda requerir reparación quirúrgica de la válvula mitral, lo cual requiere mayor investigación.
En general, el ejercicio no produce cambio o leve descenso de la IM por la resistencia vascular sistémica reducida. Sim embargo en personas con aumento de la frecuencia cardiaca o hipertensión arterial con el ejercicio puede aumentar el volumen regurgitante y la presión venosa pulmonar, ocasionando disnea.
Evaluación
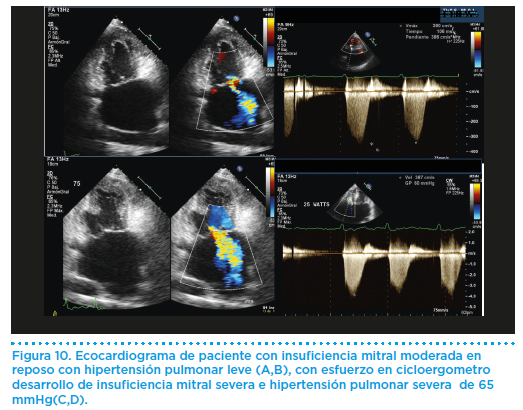
Los deportistas con insuficiencia mitral deberían someterse a revisiones cardiológicas anuales, incluyendo ecocardiograma y prueba de esfuerzo a un nivel similar al deporte practicado. El ecocadiograma permite valorar el grado de regurgitación mitral y medir los diámetros ventriculares y la presión pulmonar. Además, la presión sistólica pulmonar durante el ejercicio en cinta o en bicicleta estática (Figura 10) puede estimarse de forma no invasiva mediante ecocardiografía doppler, lo que permite tomar decisiones sobre el grado de esfuerzo que el atleta puede realizar con seguridad, particularmente en pacientes con IM severa.
En el caso especial de los pacientes con insuficiencia mitral secundaria a endocarditis previa o rotura de las cuerdas mitrales, los tejidos de las válvulas y las cuerdas suelen ser más débiles y tienen más tendencia a la rotura, por lo que las recomendaciones en estos casos son más restrictivas.
Recomendaciones
Conclusiones
Las Valvulopatías son un conjunto muy heterogéneo de alteraciones, que afectan de una u otra manera al funcionamiento cardiaco.
Es muy recomendable, el seguimiento por un cardiólogo de manera periódica, un buen seguimiento de nuestra patología es la mejor garantía de una práctica deportiva segura. Las herramientas más empleadas para el seguimiento de la patología valvular así como establecer las recomendaciones de la práctica deportiva se basan en la ecocardiografía convencional o de esfuerzo y la ergometría.
El ejercicio físico, siempre y cuando se respeten sus indicaciones, es una herramienta muy eficaz para mejorar la percepción física y mental del sujeto, disminuye el peso, mejora la vascularización periférica y la oxigenación de los tejidos, previene del fenómeno de la ateroesclerosis, mejora la vascularización cardiaca, remodela las fibras cardiacas, mejora la capacidad de transporte de oxígeno en sangre y el almacenamiento de glucógeno en la fibra muscular.
Sociedades como “La American College of Cardiology” o el “American College of Sports Medicine” abogan por la práctica deportiva razonable en pacientes con valvulopatías.
El ritmo normal del corazón se denomina ritmo sinusal, y se origina con un impulso eléctrico a nivel del nodo sinusal, localizado en la aurícula derecha del corazón, desde donde viaja hasta el nodo aurículo-ventricular, situado en la unión de las aurículas con los ventrículos y llega a los ventrículos por el haz de His y el sistema de Purkinje (ver capítulo 1).
Una arritmia es una alteración del ritmo cardiaco que se puede originar en cualquier nivel del circuito y que puede aparecer tanto en corazones sanos como con enfermedad.
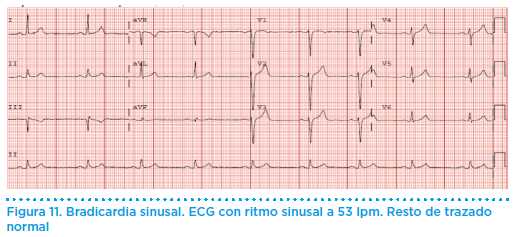
La frecuencia cardiaca normalmente oscila entre 60 y 100 latidos por minuto (lpm). En los pacientes deportistas (en ausencia de signos de cardiopatía) es frecuente la presencia de bradicardia sinusal, que se considera fisiológica o normal, con frecuencias cardiacas que oscilan entre los 40 y 60 lpm (incluso menores), debido al incremento del tono vagal promovido por el propio entrenamiento (figura 11). En estos casos, el comportamiento durante el esfuerzo es normal y se produce un incremento de la frecuencia cardíaca superior a los 120 lpm. La presencia de una bradicardia sinusal fisiológica no contraindica el deporte.
Hay dos clasificaciones fundamentales de las arritmias. Por su origen, se clasifican en:
Por la frecuencia cardiaca,
Los síntomas que pueden aparecer con la presencia de arritmias incluyen sensación de palpitaciones, mareo, dolor torácico o pérdida de conocimiento, pero también pueden pasar inadvertidas y detectarse casualmente cuando se realizan pruebas diagnósticas.
Para poder hacer el diagnóstico de una arritmia, es necesario demostrar la alteración de la actividad eléctrica cardiaca en un electrocardiograma.
Esto puede dificultar el diagnóstico en aquellas personas que tienen episodios de arritmia de forma paroxística, ya que sólo registra la actividad cardiaca en el momento en que se está realizando.
Otras pruebas útiles son el Holter y la prueba de esfuerzo. El Holter registra la actividad eléctrica durante un periodo de tiempo más prolongado (desde 24 horas hasta varios días), permitiendo detectar episodios de arritmias sintomáticos o que pasan desapercibidos. Es una herramienta muy útil para la detección de bradicardias extremas y bloqueos de la conducción cardiaca, causa importante de pérdidas del conocimiento. La prueba de esfuerzo permite en algunos casos desencadenar arritmias o ver el comportamiento de las mismas con el esfuerzo.
Cuando detectamos una arritmia es fundamental realizar un ecocardiograma para estudiar la anatomía y función del corazón, ya que su comportamiento, su tratamiento y su pronóstico difiere en función de la presencia o ausencia de cardiopatía orgánica.
El tratamiento de las arritmias cardiacas es específico y depende del tipo de arritmia, de su causa y de las características del paciente.
Las bradiarritmias patológicas, en ocasiones, pueden precisar del implante de un marcapasos para su tratamiento. Las taquiarritmias generalmente requieren el uso de terapias farmacológicas (que pueden controlar la arritmia reduciendo la frecuencia cardiaca, recuperar el ritmo sinusal y prevenir nuevos episodios).
A veces puede ser necesario realizar una cardioversión eléctrica para eliminar la arritmia (administrar un choque eléctrico mediante unas palas que se sitúan sobre el tórax, precisa sedación del paciente).
En algunos casos, es necesario realizar un estudio electrofisiológico, que permite diagnosticar las arritmias y tratar algunas de ellas mediante una ablación (que consiste en aplicar corrientes eléctricas sobre las zonas responsables de las arritmias para suprimirlas).
Finalmente, algunos pacientes tienen un riesgo de presentar arritmias potencialmente mortales. En estos casos está indicado el implante de un desfibrilador, que es un dispositivo que vigila el ritmo cardiaco y es capaz de detectar arritmias malignas y administras descargas eléctricas que eliminan la arritmia.
Dado que muchas arritmias precisan un manejo estrecho por el cardiólogo, una vez detectadas es necesaria una valoración completa y la instauración de un tratamiento individualizado. Será el cardiólogo quien recomiende en cada caso el abandono o la reintroducción de la práctica deportiva.
A continuación, revisaremos brevemente las recomendaciones sobre la práctica de deporte en pacientes con arritmias cardiacas frecuentes que no contraindican la realización de ejercicio físico.
La fibrilación auricular es la arritmia cardiaca más frecuente y está presente en alrededor del 1 % de la población. Su incidencia es mayor conforme avanza la edad, con una prevalencia del 10% en mayores de 80 años, pero puede presentarse a cualquier edad. Se debe a la pérdida del control del ritmo por el nodo sinusal, por lo que aparece un ritmo irregular y caótico. Puede aparecer en corazones sanos o con cardiopatía. El diagnóstico de fibrilación auricular es importante e implica una valoración cardiológica completa.
En relación con la práctica deportiva, si el ejercicio es el estímulo desencadenante del episodio de fibrilación auricular, el cardiólogo puede ofrecer alternativas farmacológicas e intervencionistas al paciente.Si la fibrilación auricular es permanente, los pacientes pueden realizar ejercicio físico, siempre con un buen control de la frecuencia cardiaca. En estos casos, la medición de la frecuencia cardiaca es más difícil, ya que ésta se manifiesta de manera muy irregular, por lo que se recomienda controlar la intensidad del ejercicio mediante las escalas de percepción subjetiva de esfuerzo, como la escala de Börg. Así, los pacientes deben iniciar el entrenamiento a una intensidad 10 u 11 (que corresponde con trabajo entre muy leve y leve) e ir incrementando con el tiempo sin superar nunca el valor 15.
Las taquicardias supraventriculares paroxísticas, en ausencia de cardiopatía, no contraindican la práctica de deporte. Si el ejercicio es el desencadenante, una vez más será el cardiólogo quien ofrezca alternativas terapéuticas.
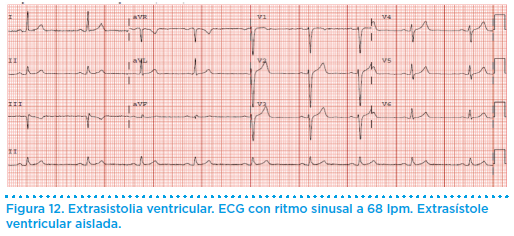
La extrasistolia ventricular es un hallazgo muy común entre los pacientes estudiados por palpitaciones (figura 12). Lo más frecuente es que no se asocien a una cardiopatía subyacente y desaparecen con el ejercicio (se valorarán mediante una prueba de esfuerzo). En estos casos el comportamiento y pronóstico de estos pacientes es benigno y no tienen ninguna contraindicación para realizar cualquier deporte. Las extrasístoles ventriculares inducidas por el ejercicio o en aquellos pacientes con cardiopatía estructural requieren un manejo individualizado y será el cardiólogo quien recomiende una actitud en relación con el entrenamiento físico.
Sanitas Hospitales ha ampliado su oferta de Cirugía Cardiaca en Madrid con el establecimiento de una red integrada que está formada por un mismo equipo ...
El Hospital La Moraleja se mantiene como 6º hospital privado con mejor reputación en el Monitor de Reputación Sanitaria 2023